
 第二章 化学反应与能量
第二章 化学反应与能量
第3节 化学反应速率与限度(3)
【化学反应限度—化学平衡状态】
【使用说明】
1、利用10分钟,先阅读必修二教材P50-53 ,将教材中重要的内容进行勾画。
2、利用20分钟完成学案,将预习中不能解决的问题标记出来,并填写到后面“我的疑惑”处。
【学习目标】
识记:可逆反应的概念;化学平衡即化学反应限度的概念。
理解:化学平衡状态的特征及影响因素。
应用:有关化学平衡的基本计算;化学平衡状态的确定。
【重点 难点】影响化学平衡状态的确定及化学平衡的计算。
预习案
1、一个化学反应在实际进行时(如化学实验、化工生产等),给定量的反应物是否会按化学方程式中的计量关系完全转变成产物?(阅读科学史话后再进行回答)
2.可逆反应:
①可逆反应:同一条件下______________和_____________均能进行的反应。 正向进行的反应叫正反应(___ ___à___ ___),逆向进行的反应叫逆反应(____ __à____ ___)。
②可逆反应在写化学方程式时不用“=”而用_________。 例如:2SO2+O2![]() 2SO3,N2+3H2
2SO3,N2+3H2![]() 2NH3。
2NH3。
③有些化学反应在同一条件下可逆程度很小(你反应倾向很小)如_______________________,
我们通常意义下不把他们称为_____________。
3、化学反应的限度——化学平衡状态
①概念:在一定条件下,当一个可逆反应进行到一定程度,___________与___________相等,反应物和生成物的___________不再改变,达到一种____________的状态,我们称为化学平衡状态。
②化学平衡状态是可逆反应的一种___________,是在给定条件下化学反应所能达到或者完成的_________, 即该反应进行的_______。化学反应的_______决定了反应物在该条件下的_________
4、化学反应条件的控制
(1)由于化学反应的速率受___________、___________、___________、___________、___________等条件的影响,因此在生产和生活中,人们希望促进_____________(提高________________,加快反应速率),___________有害的化学反应(减缓反应速率、减少有害物质的产生等等)。
(2)燃料充分燃烧条件的选择———提高燃料燃烧效率的措施
①尽可能使燃料___________,提高___________的转化率。关键是:燃料与空气或氧气要尽可能___________且空气要___________。
②尽可能充分利用燃料燃烧所放出的___________,提高___________的利用率。
(3)燃料充分燃烧的意义。
①有限的能源发挥最大的作用,节约能源;②降低污染的程度(在煤的气化过程中可以__________)
【预习自测】
1.下列说法正确的是( )
A.可逆反应的特征是正反应速率等于逆反应速率
B.在其他条件不改变时,增大压强对溶液间反应几乎无影响
C.温度升高,可以使可逆反应正反应速率加快,但逆反应速率可以不变
D.使用催化剂可以使原来不能发生的反应变为可能发生了
2.反应2SO2+O2![]() 2SO3达到平衡后,再向反应器中充入由18O组成的氧气,经一段时间后,18O可能存在于( )
2SO3达到平衡后,再向反应器中充入由18O组成的氧气,经一段时间后,18O可能存在于( )
A.生成的SO3中 B.O2和SO3中 C.剩余的SO3中 D.O2、SO2和SO3中
3.可逆反应N2+3H2![]() 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列关系中能说明反应已达到平衡状态的是( )
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列关系中能说明反应已达到平衡状态的是( )
A.3v正(N2)=v正(H2) B.v正(N2)=v逆(NH3) C.2v正(H2)=3v逆(NH3) D.v正(N2)=3v逆(H2)
4.在一定条件下,对于在密闭容器中进行的反应P(g)+Q(g)![]() R(g)+S(g),下列说法中可以充分说明这一反应已经达到平衡状态的是 ( )
R(g)+S(g),下列说法中可以充分说明这一反应已经达到平衡状态的是 ( )
A.P、Q、R、S的浓度相等 B.P、Q、R、S在容器中共存
C.P、Q、R、S的浓度不再变化 D.P、Q的反应速率相等
【我的疑惑】
探究案
探究一:认识可逆反应
例1:思考交流,下列反应是否为可逆反应?
a、 水的生成(氢气和氧气反应)与电解水生成氢气氧气。
b、 SO2溶于水和H2SO3分解
c、 二次电池的充电与放电过程
d、 SO2跟O2化合成SO3和SO3分解
e、 CO2和水通过光合作用合成糖与糖在人体内氧化产生CO2和水
f、 H2跟I2化合成HI和HI分解
探究二:化学平衡的建立及特征
例2:在500℃,101KPa时,在2L的密闭容器中加入SO2和O2,发生反应2SO2+O2![]() 2SO3(g),各物质的物质的量和反应时间数据如下表,试着思考完成下列问题。
2SO3(g),各物质的物质的量和反应时间数据如下表,试着思考完成下列问题。
(1)计算并填写表中空格
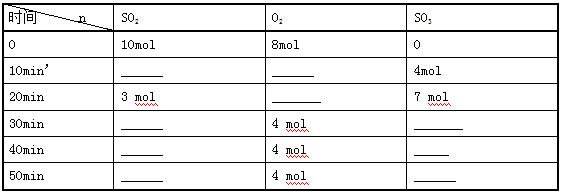
(2)对于上述反应正、逆反应速率分别指什么?
(3)请结合表中数据分析,反应过程中v正和v逆如何变化?并画出整个过程中速率—时间图像。
(4)结合表中数据分析,平衡建立的过程中,各物质的浓度变化情况并画出浓度—时间图像。
针对训练1:下列对化学反应限度及化学平衡的叙述正确的是( )
①逆反应达到化学平衡时,反应物与生成物的浓度(含量)保持不变;
②可逆反应达到化学平衡时,整个反应处于停滞状态;
③任何可逆反应都有一定的限度
④化学反应限度是不可改变的
⑤化学反应限度与时间的长短无关
探究三:化学平衡状态的标志
1、根据化学平衡状态的定义分析,化学平衡状态的外在标志是________ ____,
内在原因是_______ _______。
2、可逆反应2NO2(红棕色)![]() 2NO+O2在容积固定的密闭容器中进行,下列可以作为该反应达到化学平衡状态的依据的是( )
2NO+O2在容积固定的密闭容器中进行,下列可以作为该反应达到化学平衡状态的依据的是( )
A.单位时间内生成n mol O2同时生成2n mol NO2
B.单位时间内生成n mol O2同时生成2n mol NO
C . 单位时间内消耗n mol O2同时生成2n mol NO
D . 用NO2 、NO、 O2表示的反应速率比为2:2:1
E . 混合气体的颜色不再改变的状态
F.混合气体的密度不再改变的状态
G.混合气体的压强不再改变的状态
H . 体系中各组分的质量不再变化
I . 混合气体的平均相对分子质量不在改变
3、如果反应变成H2+I2(g) ![]() 2HI则上述E、F、G、H、I条件还能否作为判断平衡状态的依据?
2HI则上述E、F、G、H、I条件还能否作为判断平衡状态的依据?
【当堂检测】
1.在一定温度下,反应A2(g)+B2(g)![]() 2AB(g) 达到平衡状态的标志是 ( )
2AB(g) 达到平衡状态的标志是 ( )
A.单位时间生成n molA2同时生成n molAB B.容器内的总压强不随时间变化
C.单位时间生成2n molAB同时生成n molB2 D.单位时间生成n molA2同时生成n molB2
2.对于在密闭容器中、一定条件下进行的可逆反应N2(g)+3H2(g)![]() 2NH3(g),能说明反应已达到平衡状态的是( )
2NH3(g),能说明反应已达到平衡状态的是( )
A.各物质体积分数相等 B.c(NH3)保持不变
C.各物质浓度相等 D.c(NH3)∶c(N2)∶c(H2)=2∶1∶3
3.t℃时,将2 mol SO2和1 mol O2通入体积为2 L的恒温恒容密闭容器中,发生如下反应:
2SO2(g)+O2(g) ![]() 2SO3(g),2 min时反应达到化学平衡,此时测得反应物O2还剩余0.8 mol,请填写下列空白:
2SO3(g),2 min时反应达到化学平衡,此时测得反应物O2还剩余0.8 mol,请填写下列空白:
(1)从反应开始到化学平衡,生成SO3的平均反应速率为____ __;平衡时SO2转化率为_______。
(2)下列叙述能证明该反应已达到化学平衡状态的是(填标号,下同)____________。
A.容器内压强不再发生变化 B.SO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化 D.相同时间内消耗2n mol SO2的同时消耗n mol O2
E.相同时间内消耗2n mol SO2的同时生成n mol O2
(3)t2℃时,若将物质的量之比n(SO2)∶n(O2)=1∶1的混合气体通入一个恒温恒压的密闭容器中,反应达到平衡时,混合气体体积减少了20%。SO2的转化率为__________。