
 第二章 化学反应与能量
第二章 化学反应与能量
第2节 化学能与电能
【化学能转换为电能】
【使用说明】
1、利用5分钟,先阅读必修二教材P39~42,认识化学能转化为电能的基本原理,了解什么是原电池。
2、将预习中不能解决的问题标记出来,并填写到后面“我的疑惑”处。
3、利用20分钟高效完成学案。
【学习目标】
1. 了解煤发电的一般过程。
2. 理解原电池的概念、工作原理及构成条件。
3. 通过对化学能转化为电能的学习,体验科学探究的过程,理解科学探究的基本过程和方法,初步养成科学探究的能力。
【重点 难点】
重点:原电池的概念、原理、构成条件。
难点:从电子转移角度理解化学能向电能转化的本质及原电池的构成条件。
预习案
【知识准备】
1.在化学反应中,物质中化学能的变化通常表现为 的变化,即 转化为
2.金属活动性顺序表。
3.在氧化还原反应中:氧化剂 电子,发生 反应,还原剂 电子,发生 反应;氧化还原反应本质是 的过程, 引起 的重新组合,同时伴随着 的变化。
【教材助读】
1.能源的分类
(1)一次能源:
定义:
举例:
(2)二次能源:
定义:
举例:
2.火力发电原理:
(1)化石燃料(煤、石油、天然气)通过 把 转化为 ,加热使水变为水蒸气,水蒸气推动蒸汽轮机,使 能转化为 ,轮机带动发电机发电,最终转化为电能。能量转化可以总结为:
化学能 → 热能 → 机械能 → 电能
(2)火电生产过程的特点是:转换环节多,能量转化 低,浪费资源,污染环境等。
3.原电池及其工作原理
(1)概念:将 转化为 的装置叫原电池。
(2)工作原理:(以Cu、Zn和稀H2SO4原电池为例)
负极:Zn-2e-= Zn2+ (氧化反应) 正极:2H++2e-=H2↑ (还原反应)
电子由 (锌)流向 (铜)
【预习自测】
1.火力发电是通过化石燃料燃烧,使化石燃料中的化学能转化为电能,其能量转化方式正确的是( )
A.化学能→电能 B.化学能→机械能→电能
C.化学能→热能→电能 D.化学能→热能→机械能→电能.
2.下列说法中正确的是( )
A.原电池是把电能转化为化学能的装置 B.原电池电子流出极是负极,发生氧化反应
C.原电池两极均发生氧化反应 D.非氧化还原反应也可以构成原电池
3.某金属能和盐酸反应生成氢气,该金属与锌组成原电池时,锌为负极,则该金属可能为( ) A.铝 B.铜 C.锡 D.银
【我的疑惑】
探究案
【质疑探究】
探究一 原电池工作原理
分组实验探究:
实验1:铜片插入稀硫酸 现象:铜片表面
实验2:锌片插入稀硫酸 现象:锌片表面
实验3:铜片和锌片连在一起插入稀硫酸
现象:铜片表面 ;锌片
问题1:通过实验1、2中的现象对比,能够得出什么结论?
问题2:锌片和铜片用导线连接后插入稀硫酸中,铜片表面有气泡产生,你认为这种气体可能是什么?
问题3:铜片和稀硫酸不反应,为什么实验3中铜片表面会有气泡产生呢?
实验4:铜片和锌片连在一起插入稀硫酸,且铜片和锌片之间连接一电流表
现象:铜片表面 ;锌片
电流表指针
问题4:灵敏电流计的指针发生偏转,说明有电流通过,你如何解释这一现象?
问题5:什么是原电池?
问题6:该装置的正负极分别是什么?
问题7:试着从得失电子角度分别表示出正、负极上所发生的反应。并从氧化还原角度分析哪一极发生氧化反应,哪一极发生还原反应。
问题8:根据问题7写出整个装置中发生的总反应方程式。
问题9:描述铜-锌-硫酸原电池的工作原理。
探究二 原电池的构成条件
实验5: 根据上述铜-锌-硫酸原电池的装置和工作原理,各小组利用所给药品每组至少设计一个原电池装置,并画出装置图示,试着写出电池的正负极反应和总反应。
 问题10:根据本组设计原电池的过程,并分析下列图示能否构成原电池,讨论构成原电池需要哪些条件?
问题10:根据本组设计原电池的过程,并分析下列图示能否构成原电池,讨论构成原电池需要哪些条件?
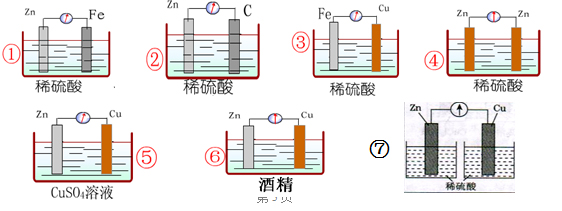
以上装置能构成原电池的是
总结:原电池的构成条件
(1)
(2)
(3)
问题11:根据探究实验和小组讨论结果,总结如何判断原电池的正负极?
【当堂检测】
1.对于原电池的电极名称,下列叙述中错误的是( )
A.电子流入的一极为正极
B.电子流入的一极为负极
C.发生还原反应的一极为正极
D.发生氧化反应的一极为正极
2.关于原电池的叙述中正确的是 ( )
A.构成原电池的电极是两种不同的金属 B.原电池是将化学能转化为电能的装置
C.原电池负极发生的电极反应是还原反应
D.原电池正极是还原剂,总是溶液中的阳离子在此被还原
3.在以稀硫酸为电解质溶液的铜—锌原电池中,下列判断正确的是( )
A.溶液的酸性逐渐增强 B.铜片逐渐溶解
C.溶液中H+向锌片作定向移动 D.锌片是负极并被氧化
4.下列烧杯中盛放的都是稀硫酸,在铜电极上能产生氢气( )
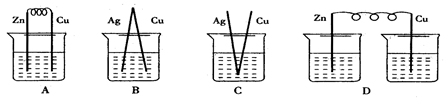
【我的收获】