 第三章 有机化合物
第三章 有机化合物
第3节 生活中两种常见的有机物——乙醇
【使用说明】
1、利用10分钟,先阅读必修二P73-75页前三行 ,将教材中重要的内容进行勾画。
2、利用20分钟完成学案,将预习中不能解决的问题标记出来,并填写到后面“我的疑惑”处。
【学习目标】
1、通过预习,了解烃的衍生物与官能团的定义,能说出乙醇的物理性质,掌握乙醇的结构。
2、通过钠与乙醇反应的实验,理解钠与乙醇反应的特点,提高动手能力、观察能力、思维能力。
3、通过乙醇催化氧化的实验,理解催化氧化的机理,并认识官能团与有机物性质的关系,建立“结构决定性质”的有机物学习模式;通过小组合作探究,培养问题意识和善于合作的团队精神。
【重点难点】重点:乙醇的结构特点和主要化学性质。 难点:乙醇的化学性质。
预习案
【知识准备】
1、通过上网或资料查找,了解生活中各种酒类的酒精含量、白酒的度数所表示的含义以及不同浓度医用酒精的用途等。
2、钠与水反应的化学方程式: 反应类型
反应现象:
原因:
【教材助读】
一、烃的衍生物和官能团 (通过阅读教材,了解烃的衍生物和官能团的定义,能列举一些烃的衍生物,指出一些常见有机物中的官能团,会书写官能团的结构简式和名称。)
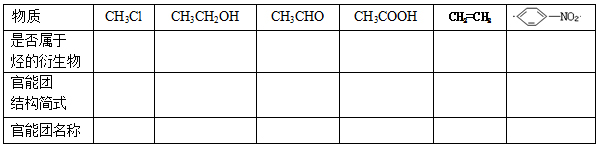
1、烃的衍生物:烃分子中的 被其他 所取代的而生成的一系列化合物称为烃的衍生物。例如: 等都属于烃的衍生物。
2、官能团:决定有机化合物的 的 叫做官能团。
二、乙醇的物理性质 (通过教材和生活经验,能说出乙醇的物理性质,并解释一些有关的现象。)
3、乙醇俗称 ,是 色有 的 体,密度比水 ,沸点 ,乙醇易 ,能够溶解多种 和 ,能与水以任意比例 。
三、乙醇的结构
4、书写出乙醇的分子式、结构式、结构简式,并明确乙醇的官能团。

四、乙醇的化学性质 (能书写并识记乙醇与钠、乙醇燃烧、乙醇催化氧化反应方程式;知道乙醇可以被哪些强氧化剂氧化。)
5、乙醇与钠反应的化学方程式: 反应类型
推测反应现象:
6、乙醇的氧化反应
(1)燃烧:产生 色火焰,放出大量的热。方程式:
(2)催化氧化:乙醇在 做催化剂的条件下,可以被氧气氧化成乙醛。
化学方程式:
(3)被氧化剂氧化:乙醇还可以被酸性 溶液或酸性 溶液反应,被直接氧化成为 。
【预习自测】
1、请判断下列物质是否属于烃的衍生物,写出下列有机物的官能团和名称
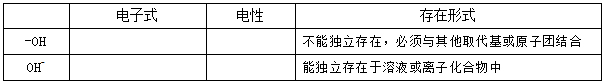
2、-OH 与OH_有什么区别?请填写下表。
3、下列有关乙醇的物理性质的应用中不正确的是( )
A.由于乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去。
B.乙醇不能用于萃取碘水中的碘。
C.由于乙醇能够以任意比溶解于水,所以酒厂可以勾兑各种浓度的酒。
D.由于乙醇容易挥发,所以才有俗语“酒香不怕巷子深”的说法。
4、如何检验酒精中是否含有水,现象如何?酒精中含有的水,应该怎样除去?
【我的疑惑】____________________ _ _________________________
探究案
【探究目标】
1、通过钠与乙醇反应的实验,对比钠与水反应现象的不同,理解钠与乙醇反应的特点。
2、通过乙醇催化氧化的实验,理解催化氧化的机理,并认识官能团与有机物性质的关系。
探究一:乙醇与钠反应
1、实验操作:取一支试管,加入2—3ml的乙醇,夹取一小块金属钠,用滤纸吸干表面的煤油,用小刀切去外面的氧化层,放入试管中,观察现象。
实验分析:(1)与钠与水反应的现象对比并分析原因?(2)怎样检验生成的气体是什么?
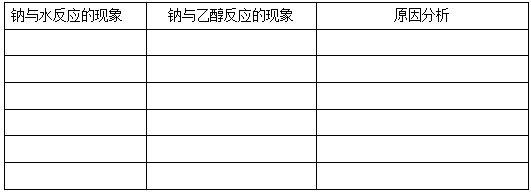
实验结论:
2、(1)C2H6与C2H60分子式中相差一个氧原子,请根据乙烷的结构推断C2H60可能的结构。
(2)请根据乙醇与钠的反应,设计实验确定乙醇的结构?
探究二:乙醇的氧化反应
1、 实验操作:用小试管取2~3mL无水乙醇,用酒精灯外焰加热一端绕成螺旋状的铜丝至红热,将铜丝趁热插到盛有乙醇的试管底部,反复操作几次,观察铜丝颜色和液体气味的变化。
实验现象:①加热螺旋状的铜丝, 铜丝的颜色变化:__ __ → ___ __。②将铜丝插到乙醇中,铜丝的颜色变化:__ __ → ___ __,试管中的液体有 气味。
实验分析:(1)通过实验现象分析乙醇催化氧化的机理,写出反应方程式。
反应方程式①:
②:
总反应为:
(2)铜丝在反应前后质量是否有变化,乙醇催化氧化过程中Cu起到什么作用。
![]() (3)具有刺激性气味的液体是乙醛( ),对比乙醇和乙醛的结构,分析反应过程中乙醇的断键部位。
(3)具有刺激性气味的液体是乙醛( ),对比乙醇和乙醛的结构,分析反应过程中乙醇的断键部位。
2、你知道交警检查司机是否酒驾的装置中,主要含有什么物质吗?检验原理是什么?
【小结】如右图所示,乙醇与钠反应时在何处断键( )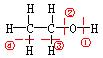
乙醇发生催化氧化反应时在何处断键 ( )
巩固案
1、比较乙烷和乙醇的结构,下列说法错误的是( )
A.两个碳原子都以单键相连B.乙醇可以看成是乙烷分子中的一个氢原子被羟基取代后的产物
C.分子里含6个相同的氢原子D.乙醇与钠反应平缓,所以乙醇羟基上的氢不如水中的氢活泼
2、能证明乙醇分子中有一个羟基的事实是( )
A.乙醇完全燃烧生成CO2和H2O B.乙醇能与水以任意比混溶
C.0.1mol乙醇与足量钠反应生成0.05mol H2 D.乙醇能发生氧化反应
3、下关于乙醇的说法正确的是( )
A.乙醇在水溶液中能电离出H+ ,乙醇是电解质。
B.乙醇结构中有-OH,所以乙醇显碱性。
C.乙醇分子中只有乙基上的氢原子可被钠置换。
D.人们利用白酒浸泡中药制成药酒,是利用乙醇可以溶解许多无机化合物和有机化合物。
4、CH2=CHCH2OH可能发生的反应类型有( )
①加成反应 ②氧化反应 ③置换反应 ④中和反应
A、①② B、①②③ C、①③④ D、①②③④